Im Spannungsfeld – Schutzkleidung in der Zytostatika-Zubereitung
Ähnlich restriktive Anforderungen wie für den Personenschutz gelten auch für den Produktschutz bei der Herstellung applikationsfertiger Zytostatika-Zubereitungen. Diese werden in den meisten Fällen parenteral verabreicht. Sterilität und Partikelfreiheit der Herstellungsumgebung sind daher oberstes Gebot.
Mit Änderung der Apothekenbetriebsordnung [4] im Jahr 2012 wurden deshalb die Vorgaben für die aseptische Herstellung weiter konkretisiert. Der Prozess orientiert sich seitdem eng an Anhang 1 zum EG-Leitfaden der Guten Herstellungspraxis [5] und sieht für die Herstellungsumgebung eng definierte Reinheitsklassen vor.
Während die eigentlichen Zubereitungsmanipulationen immer in einem Bereich der Reinheitsklasse A stattfinden müssen – in der Regel ist dies der Arbeitsraum einer Sicherheitswerkbank - , muss die direkte Umgebung normalerweise der Klasse B entsprechen (Ausnahmen: Klasse C bei Nachweis der Arzneimittelqualität und entsprechender Validierung des Verfahrens oder Klasse D beim Einsatz eines Isolators). Das Personal, das sich in dieser Umgebung aufhält, hat durch sein Verhalten und seine Ausstattung dazu beizutragen, dass die geforderte Reinheitsklasse erhalten bleibt.
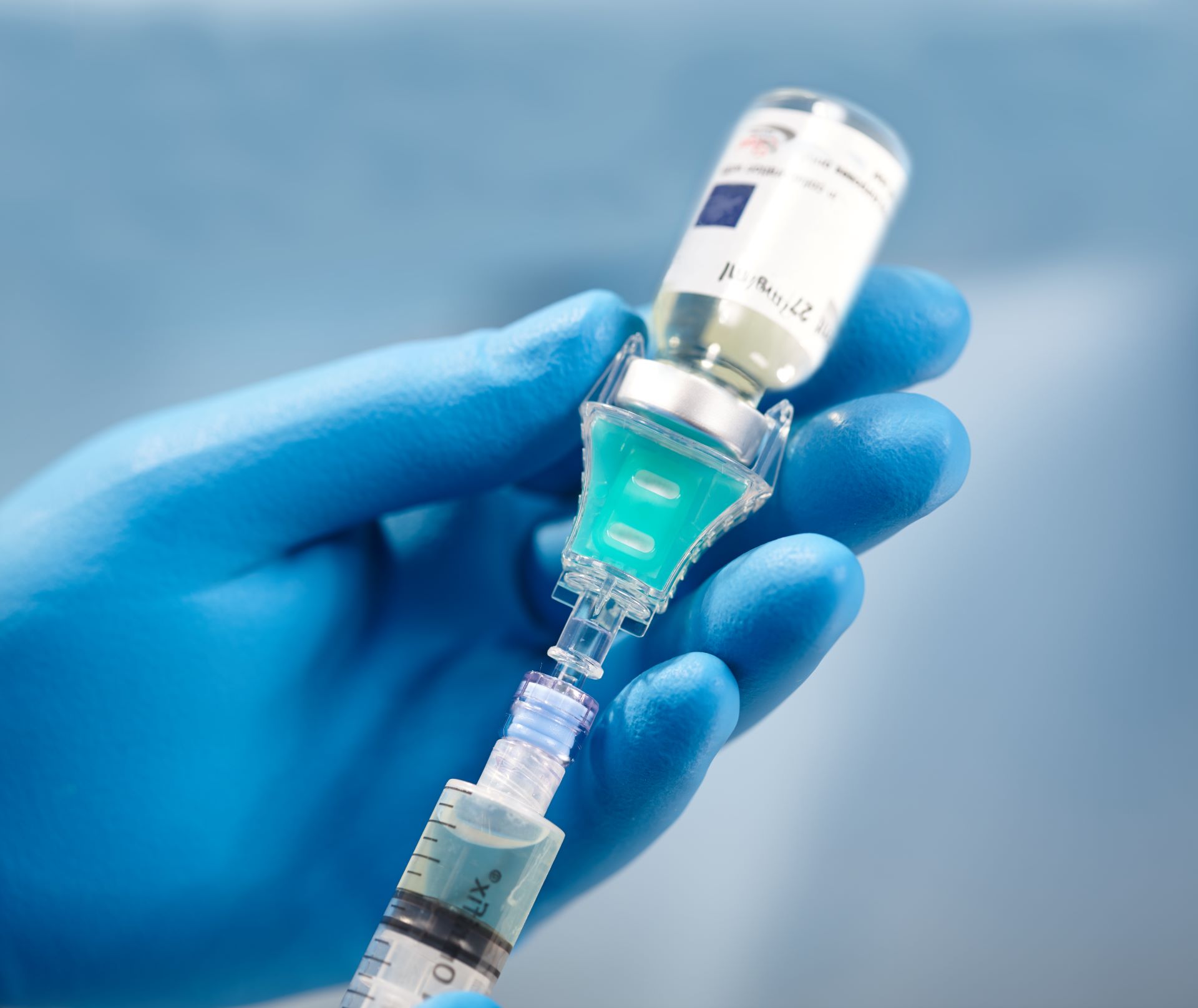
Die Schutzkleidung spielt dabei eine entscheidende Rolle. Sie stellt sicher, dass möglichst wenig Keime und Partikel vom Körper des Trägers in die reine Umgebung gelangen. Reinraumbekleidung ist deshalb so ausgelegt, dass sie den Körper fast vollständig bedeckt. In ihrer Funktion als Filter soll sie Partikel zurückhalten, Luft jedoch hindurchtreten lassen, um ein „Ausblasen“ der Partikel an Kragen und Ärmeln zu verhindern. Außerdem muss durch eine entsprechende Vorbehandlung dafür gesorgt werden, dass die verwendete Schutzkleidung keimfrei ist und selber keine Partikel abgibt.
Während der Herstellungssimulation wurden typische Transferschritte wie z. B. die Entnahme und das Zuspritzen kleiner Lösungsvolumina durchgeführt. Am Gesamtprozess waren zwei Personen – eine erfahrene PTA als „Hersteller“ und ein „Zureicher“ – beteiligt. Das Vorgehen basierte auf einem etablierten Verfahren zur mikrobiologischen Herstellungskontrolle in Apotheken [1]. Im Zuge der Herstellung wurden insgesamt 120 Infusionsbeutel mit steriler Nährlösung befüllt. Dazu wurden in 60 Abfüllläufen 960 definierte Manipulationen durchgeführt, die an keiner Stelle des Zubereitungsprozesses zur Verkeimung der Nährlösung führen durften. Zur Bewertung der aseptischen Arbeitsweise wurden die befüllten Infusionsbeutel bebrütet und visuell auf Keimwachstum überprüft. Die mikrobiologische Belastung des Arbeitsbereiches wurde zudem mithilfe von Sedimentations- und Abklatschplatten kontrolliert.
Stand bei der Zubereitung von Zytostatika bis vor wenigen Jahren noch das Personal im Mittelpunkt der Schutzaktivitäten, konzentrieren sich die Bemühungen derzeit immer mehr auf eine möglichst umfassende Hygiene zum Schutz der hergestellten Produkte. Die Reinraumeignung der eingesetzten Schutzkleidung spielt deshalb bei der Auswahl eine wesentliche Rolle.
Obwohl Einwegkleidung aufgrund ihrer dokumentierten Integrität bessere Voraussetzungen zur Umsetzung der Personenschutzanforderungen bietet, ist in modernen Zubereitungslabors Mehrwegkleidung auf dem Vormarsch. Spezielle Aufbereitungsverfahren und eine hohe Atmungsaktivität sorgen dafür, dass sich hiermit die geforderten Reinraumeigenschaften leichter umsetzen lassen. Als Folge der Aufbereitung ist allerdings mit einem Nachlassen der Dichtigkeit gegenüber Außenkontaminationen zu rechnen. Da jedoch weder der Personen- noch der Produktschutz vernachlässigt werden dürfen, stellt sich die Frage, inwieweit sich alle gesetzlichen Anforderungen durch die am Markt verfügbare und für aseptische CMR-Zubereitungsarbeiten vorgesehene Schutzkleidung erfüllen lassen.
Die Antwort fällt immer noch ernüchternd aus, auch wenn sich gegenüber einer vor wenigen Jahren durchgeführten Situationsbetrachtung [6] Verbesserungen abzeichnen. Nach wie vor sind kaum Produkte erhältlich, die einerseits als Chemikalienschutzkleidung der Kategorie III zertifiziert sind, andererseits aber vollständig die Ansprüche einer reinen Umgebung der GMP-Klasse B erfüllen. Es zeichnet sich jedoch eine Verbesserung der Marktsituation ab. Inzwischen wird ein weitgehend permeationsbeständiges und dennoch atmungsaktives Einmalmaterial in einer speziell für den Einsatz im Reinraum vorbehandelten Ausführung vertrieben. Chemikalienschutzkleidung aus diesem Material kann also beides bieten: ausreichenden Schutz gegenüber toxischen Flüssigkeitsspritzern und gute Reinraumeigenschaften durch den Rückhalt von Körperpartikeln bei gleichzeitiger eigener Partikelarmut.
Auch wenn bislang also immer noch kein breites Angebot an Schutzkleidung existiert, die alle vorgeschriebenen Leistungsanforderungen erfüllt, stehen inzwischen ausgewählte Produkte zur Verfügung, die die bisherigen unzureichenden oder provisorischen Lösungen vorschriftenkonform ersetzen können. Auch bei ihrer Verwendung ist allerdings eine systematische Gefährdungsbeurteilung unabdingbar.
[6] Klein, M. (2012) Personenschutz durch Reinraumkleidung in der Zytostatika-Herstellung. Pharm. Ind. 11:1774-1780.
Das könnte dich auch interessieren

 Deutsch
Deutsch
 English
English



.png)
.png)
